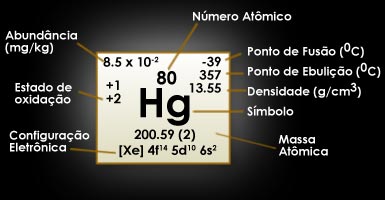
Mercúrio - Hg
Forma química na solução: Hg2+
Cor da solução aquosa: Incolor
Compatibilidade Química: Pode ser diluída com HNO3. Evitar misturar com matrizes de outros metais contendo HCl ou cloretos e cátions redutores com Fe2+ e Sn2+. Precipita com a maioria dos ânions como Br-, I-, CN-, OH-, CO32-, CNO-, CrO42- e S2- sendo que grande parte destes pptos. dissolvem em meio HNO3.
Estabilidade: A solução é estável por anos em frascos de polietileno (LDPE) em concentrações de 1000 – 10.000 mg/L em HNO3 5%. Em baixas concentrações o Hg sobre adsorção pelo LDPE..Em concentrações de 0,002 – 0,100 mg/L é estável em HNO3 10% em frasco de vidro. De 1-100 mg/L é estável em frasco de vidro em HNO3 7%.
Preparação de Amostras:O metal é atacado facilmente pelo HNO3 concentrado formando sal mercúrico. Com HNO3 diluido forma mistura de sal mercuroso e mercúrico. O sal mercuroso precipita com o ânion cloreto. Seus óxidos são solúveis em HNO3. Minerais como o Cinábrio é atacado pelo HNO3. Compostos orgânicos podem ser digeridos com HNO3, mas nunca analisar nas cinzas devido a volatilidade do Hg. Compostos organomercúricos requerem procedimentos especiais e devem ser digeridos em frascos fechados a quente com HNO3 e H2SO4. Se necessário adicionar (NH4)2S2O8 para facilitar a digestão da matéria orgânica.
Manuseio e armazenagem: Manter o frasco fechado quando não estiver usando. Armazenar a 20,sup>oC +/- 5oC. Evitar retorno de solução para o frasco. Não pipetar diretamente do frasco para evitar contaminações.
Informações espectrais:
Cor da solução aquosa: Incolor
Compatibilidade Química: Pode ser diluída com HNO3. Evitar misturar com matrizes de outros metais contendo HCl ou cloretos e cátions redutores com Fe2+ e Sn2+. Precipita com a maioria dos ânions como Br-, I-, CN-, OH-, CO32-, CNO-, CrO42- e S2- sendo que grande parte destes pptos. dissolvem em meio HNO3.
Estabilidade: A solução é estável por anos em frascos de polietileno (LDPE) em concentrações de 1000 – 10.000 mg/L em HNO3 5%. Em baixas concentrações o Hg sobre adsorção pelo LDPE..Em concentrações de 0,002 – 0,100 mg/L é estável em HNO3 10% em frasco de vidro. De 1-100 mg/L é estável em frasco de vidro em HNO3 7%.
Preparação de Amostras:O metal é atacado facilmente pelo HNO3 concentrado formando sal mercúrico. Com HNO3 diluido forma mistura de sal mercuroso e mercúrico. O sal mercuroso precipita com o ânion cloreto. Seus óxidos são solúveis em HNO3. Minerais como o Cinábrio é atacado pelo HNO3. Compostos orgânicos podem ser digeridos com HNO3, mas nunca analisar nas cinzas devido a volatilidade do Hg. Compostos organomercúricos requerem procedimentos especiais e devem ser digeridos em frascos fechados a quente com HNO3 e H2SO4. Se necessário adicionar (NH4)2S2O8 para facilitar a digestão da matéria orgânica.
Manuseio e armazenagem: Manter o frasco fechado quando não estiver usando. Armazenar a 20,sup>oC +/- 5oC. Evitar retorno de solução para o frasco. Não pipetar diretamente do frasco para evitar contaminações.
Informações espectrais:
| Técnica | Linhas (nm) | Limite de Detecção LD (mg/L) | Ordem | Tipo | Interferência |
|---|---|---|---|---|---|
| ICP-AES | 184,950 | 0,0085 | 1 | átomo | |
| ICP-AES | 194,227 | 0,005 | íon | V | |
| ICP-AES | 253,652 | 0,03 | 1 | átomo | Ta, Th ,Rh , Fe, U, Co |
| ICP-MS | 202 uma | 9 ppt | ----- | M+ | 186W16O |
| FAAS | 253,6 | 0,2 (ar-acetileno) | 1 | átomo | Interferência podem ser oriundas de diferentes respostas na chama pelos sais Hg2+ e Hg22+. Adicionar SnCl2 antes da análise. Eliminação de interferentes são obtidos por análise do vapor Hg a frio (CVAAS) com LD de 0,00002 mg/L |