Tabela Periódica - Guia dos Elementos
Outras Variáveis Importantes
Bifenilas policlorados ( PCBs) são uma classe de compostos orgânicos com 1 a 10 átomos de cloro ligados oriundos do Bifenilo [CAS 92-52-4] e fómula C12H10, que é uma molécula composta de dois anéis de benzeno.
Todos os átomos de hidrogênio das bifenilas podem ser substituidos por átomos de cloro.

No total são possíveis 209 congêneros como mostra a tabela abaixo:
| PCBs Homólogos | PCBs Homólogos (Nome Inglês) | Número de Cloro Substituintes | Número de Congêneros |
| Monoclorobifenila | Monochlorobiphenyl | 1 | 3 |
| Diclorobifenila | Dichlorobiphenyl | 2 | 12 |
| Triclorobifenila | Trichlorobiphenyl | 3 | 24 |
| Tetraclorobifenila | Tetrachlorobiphenyl | 4 | 42 |
| Pentaclorobifenila | Pentachlorobiphenyl | 5 | 46 |
| Hexaclorobifenila | Hexachlorobiphenyl | 6 | 42 |
| Heptaclorobifenila | Heptachlorobiphenyl | 7 | 24 |
| Octaclorobifenila | Octachlorobiphenyl | 8 | 12 |
| Nonaclorobifenila | Nonachlorobiphenyl | 9 | 3 |
| Decaclorobifenila | Decachlorobiphenyl | 10 | 1 |
Os principais PCBs produzidos na forma de misturas com o nome Aroclor são:
Aroclor 1210 (PCB-1210) Aroclor 1248 (PCB-1248)
Aroclor 1216 (PCB-1216) Aroclor 1250 (PCB-1250)
Aroclor 1221 (PCB-1221) Aroclor 1252 (PCB-1252)
Aroclor 1231 (PCB-1231) Aroclor 1254 (PCB-1254)
Aroclor 1232 (PCB-1232) Aroclor 1260 (PCB-1260)
Aroclor 1240 (PCB-1240) Aroclor 1262 (PCB-1262)
Aroclor 1242 (PCB-1242) Aroclor 1268 (PCB-1268)
Os primeiros 2 digitos indicam o número de carbonos no anel e os 2 digitos finais o teor de cloro na mistura de PCBs.
Por exemplo: PCB-1240 ou Aroclor 1240, o 12 indica o número 12 carbonos na cadeia e o 40 significa um teor de
40% de cloro em peso no PCB.
Os PCBs foram amplamente utilizados como fluidos dielétricos e de transferência de calor por exemplo, em transformadores , capacitores e motores elétricos .
Devido a toxicidade dos PCBs e classificação como poluente orgânico persistente (POP) , a produção de PCBs foi proibido pelo Congresso dos Estados Unidos em 1979 e pela Convenção de Estocolmo sobre Poluentes Orgânicos Persistentes em 2001.
No Brasil são conhecidos como Ascarel, mas também recebem nomes diversos como Aroclor, Therminol, Fenclor e etc, de acordo com o fabricante.
As preocupações sobre a toxicidade dos PCBs estão em grande parte compartilharem semelhança estrutural e modo de toxicidade. Efeitos tóxicos, como desregulação endócrina e neurotoxicidade também estão associados com outros compostos deste grupo.
A toxicidade do PCB era conhecido desde antes de sua primeira produção comercial por meio de pesquisas feitas por empresas produtoras na década de 1930, no entanto, essas conclusões foram consideradas insignificantes. A toxicidade dos PCBs para os animais foi notado pela primeira vez na década de 1970, quando cadáveres de aves marinhas emagrecidas com níveis muito elevados de PCBs no corpo foram levadas até as praias.
A toxicidade dos PCBs varia consideravelmente entre os congêneres. Os PCBs coplanares, conhecidos como PCBs não-ortos porque eles não são substituídos nas posições orto do anel aromático (Ex. congênero PCB 77, 126, 169, etc), tendem a ter propriedades semelhantes com a dioxina e em geral estão entre as congêneres mais tóxico.
Porque PCBs são quase invariavelmente encontrado em misturas complexas, o conceito de fatores de equivalência tóxica ( FET ou TEF) foi desenvolvido para facilitar a avaliação de riscos e controlo regulamentar, onde os mais congêneres PCBs mais tóxicos são atribuídos valores mais elevados TEF em uma escala de 0 a 1.
Um dos compostos mais tóxicos conhecidos, 2,3,7,8-tetracloro [p] dioxina , é atribuído um TEF de 1. Os PCBs também demonstraram efeitos tóxicos e mutagênicos, interferindo com hormônios no organismo.
PCBs, dependendo dos congêneres, imitam e inibem o estradiol , o principal hormônio sexual feminino. A imitação do composto de estrogênio pode alimentar células de câncer de mama dependente de estrogênio, e possivelmente pode causar outros tipos de câncer, como o de útero ou cervical. Inibição de estradiol pode levar a sérios problemas de desenvolvimento para machos e fêmeas, inclusive sexual, no desenvolvimento esquelético e mental.
Os PCBs são inodoros , insípidos , de cor transparente a amarelo-pálido, líquidos viscoso (misturas altamente cloradas são mais viscosos e mais amarelo).
Eles são formados por cloração eletrofílica da do bifenilo com cloro gás. Teoricamente, 209 diferentes congêneros são possíveis, embora apenas cerca de 130 são encontradas em misturas comerciais.
Os PCBs têm baixa solubilidades em água de 0,0027 a 0,42 ng / L para os Aroclors, e baixa pressão de vapor à temperatura ambiente, mas eles têm solubilidades alta na maioria dos orgânicos solventes orgânicos , óleos e gorduras.
Eles possuem alta constante dielétrica , alta condutividade térmica , elevados pontos de fulgor (170 - 380 ° C) e são quimicamente inertes, sendo extremamente resistente à oxidação , redução , adição , eliminação e substituição eletrofílica.
A densidade varia 1,182 a 1,566 kg/L. Outras propriedades físicas e químicas variam muito em toda a classe. Como aumenta o grau de cloração, ponto de fusão e lipofilicidade aumentam e diminui a pressão de vapor e solubilidade em água.
Os PCBs são compostos muito estáveis e não se decompõem facilmente. A sua destruição por processos químicos, térmicos e bioquímicos é extremamente difícil, e apresentam risco de gerar substâncias extremamente tóxicas como dibenzodioxinas e dibenzofuranos por oxidação parcial.
Degradação como um tratamento de PCBs indesejados geralmente requer altas temperaturas ou catalisadores. Sua utilidade comercial foi amplamente baseado em sua estabilidade química, incluindo baixa inflamabilidade , e desejável propriedades físicas, incluindo propriedades de isolamento elétrico.
Suas estabilidades química e física também tem sido responsáveis pela sua persistência de continuar no meio ambiente, e tem se pago um alto preço para controlar a contaminação ambiental mesmo após décadas depois de não serem mais produzidos.
Devido à sua baixa pressão de vapor , os PCBs acumulam principalmente na água , na fração orgânica do solo , e em organismos . Apesar de sua hidrofobicidade , o imenso volume de água nos oceanos ainda é capaz de dissolver uma quantidade significativa de PCBs.
No entanto, um pequeno volume de PCBs foi detectado em toda a atmosfera, a partir das áreas mais urbanizadas, que são os centros de poluição dos PCBs, para as regiões ao norte do Círculo Ártico.
Enquanto a hidrosfera é o principal reservatório, a atmosfera serve como a principal rota para o transporte global de PCBs, particularmente para os congéneres com 1 a 4 átomos de cloro.
Concentrações atmosféricas de PCBs tendem a ser mais baixa em áreas rurais, onde são tipicamente na faixa de picogramas por faixa metro cúbico, superior em áreas suburbanas e urbanas, e maior nos centros urbanos, onde eles podem chegar a 1 ng / m³ ou mais.
Em Milwaukee (USA), uma concentração atmosférica de 1,9 ng / m3 foi medido.
As concentrações tão elevadas quanto 35 ng / m3, 10 vezes maior do que o limite de orientação EPA de 3,4 ng / m3, foram encontrados dentro de algumas casas nos EUA.
A volatilização de PCBs no solo achado ser a principal fonte de PCBs na atmosfera, mas a pesquisa recente sugere que a ventilação do ar interior dos edifícios contaminados é a principal fonte de contaminação PCB na atmosfera.
Na atmosfera, os PCBs podem ser degradados por radicais hidroxila , ou diretamente por fotólise da ligação carbono - cloro.
Na biosfera , PCBs pode ser degradada por algumas bactérias ou eucariotas , mas a velocidade da reação depende tanto o número e da disposição dos átomos de cloro na molécula: PCBs menos substituído, meta-ou para substituídos sofrem biodegradação mais rápida do que congêneres de PCBs mais substituídos.
Nas bactérias, os PCBs , poderão ser desclorados através da descloração redutiva , ou oxidado pelo enzima dioxigenase. Em eucariotes, os PCBs podem ser oxidados pelo enzima citocromo P450.
No Brasil não há regulamentação para a presença de PCBs em água ou efluentes.
Muitos compostos orgânicos têm sido detectados em águas subterrâneas e superficiais.
A maioria das contaminações de águas subterrâneas estão relacionadas a vazamento de combustíveis e solventes, tanques de armazenagem, aterros sanitários, práticas agrícolas e eliminação de resíduos.
Na maioria das vezes a causa de contaminação de alguns aquíferos e águas superficiais nunca é estabelecida corretamente.
Contaminação pode ser devido a atividades fabris passadas, despejos de resíduos domésticos e industriais ou a descargas ilegais.
Os compostos organoclorados e aromáticos, largamente usados como solventes, e os trihalometanos, estão presentes na maioria dos sistemas de tratamento de água, especialmente aqueles que utilizam água superficial como fonte de abastecimento.
Estudos toxicológicos em animais têm mostrado que alguns desses produtos orgânicos têm o potencial teratogênico ou carcinogênico em seres humanos.
Para minimizar esses riscos para a saúde, a detecção e quantificação exata de compostos
orgânicos é de fundamental importância.
Este grupo compreende todos os compostos que podem ser extraídos da fase aquosa pela passagem de um gás inerte como nitrogênio ou hélio, para serem analisados em seguida em um cromatógrafo a gás (CG) Os principais são listados a seguir, com as respectivas especificações, se presentes na portaria de água potável do Ministério da Saúde:
| Nome Português | Nome Inglês | Nome Comum | Fórmula | CAS | (µg/L) Máx. Portaria 518 |
| Benzeno | Benzene | Benzol | C6H6 | 71-43-2 | 5 |
| Bromobenzeno | Bromobenzene | Monobromobenzeno | C6H6Br | 108-86-1 | ---- |
| Bromoclorometano | Bromochloromethane | Clorobrometo de metileno | CH2ClBr | 74-97-5 | ----- |
| n-Butibenzeno | Bromodichloromethane | Diclorobromometano | CHBrCl2 | 75-27-4 | ----- |
| sec-Butilbenzeno | sec-Butylbenzene | s-Butilbenzeno | C10H14 | 135-98-8 | ----- |
| tert-Butilbenzeno | tert-Butylbenzene | t-Butilbenzeno | C10H14 | 98-06-6 | ----- |
| Cloreto de Vinila | Vinyl Chloride | Cloreto de vinila | C2H3Cl | 75-01-4 | 5 |
| Clorobenzeno | Chlorobenzene | Monoclorobenzeno | C6H5Cl | 108-90-7 | 120 |
| Cloroetano | Chloroethane | Cloreto de etila | C2H5Cl | 75-00-3 | ----- |
| Clorometano | Chloromethane | Cloreto de metila | CH3Cl | 74-87-3 | ----- |
| 4-Clorotolueno | 4-Chlorotoluene | p-clorotolueno | C7H7Cl | 106-43-4 | ----- |
| 2-Clorotolueno | 2-Chlorotoluene | o-clorotolueno | C7H7Cl | 95-49-8 | |
| 3-Clorotolueno | 3-Chlorotoluene | m-clorotolueno | C7H7Cl | 108-41-8 | ----- |
| Dibromoclorometano | Dibromochloromethane | Monoclodibromometano | CHBr2Cl | 124-48-1 | ----- |
| 1,2-Dibromoetano | 1,2-Dibromoethane | Brometo de etileno | C2H4Br2 | 106-93-4 | ----- |
| Dibromometano | Dibromomethane | Brometo de Metileno | CH2Br2 | 74-95-3 | ----- |
| 1,3-Diclorobenzeno | 1,3-Dichlorobenzene | m-Diclorobenzeno | C6H4Cl2 | 541-73-1 | ----- |
| 1,4-Diclorobenzeno | 1,4-Dichlorobenzene | p-Diclorobenzeno | C6H4Cl2 | 106-46-7 | ----- |
| 1,2-Diclorobenzeno | 1,2-Dichlorobenzene | o-Diclorobenzeno | C6H4Cl2 | 95-50-1 | ----- |
| Diclorodifluorometano | Dichlorodifluoromethane | Freon 12 | CCl2F2 | 75-71-8 | ----- |
| 1,1-Dicloroetano | 1,1-Dichloroethane | cloreto de etilideno | C2H4Cl2 | 75-34-3 | ----- |
| 1,2-Dicloroetano | 1,2-dichloroethane | Cloreto de Etileno | C2H4Cl2 | 107-06-2 | 10 |
| cis-1,2-Dicloroeteno | cis-1,2-Dichloroethene | cis-dicloroetileno | C2H2Cl2 | 156-59-2 | ----- |
| trans-1,2-Dicloroeteno | trans-1,2-Dichloroethene | trans-dicloroetileno | C2H2Cl2 | 156-60-5 | ----- |
| 1,1-Dicloroeteno | 1,1-Dichloroethene | Cloreto de vinilideno | C2H2Cl2 | 75-35-4 | 30 |
| Diclorometano | Dicloromethane | Cloreto de Metileno | CH2Cl2 | 75-09-2 | 20 |
| 2,2-Dicloropropano | 2,2-Dichloropropane | Dicloreto de propileno | C3H6Cl2 | 78-87-5 | ----- |
| 1,2-Dicloropropano | 1,2-Dichloropropane | Dicloreto de propileno | C3H6Cl2 | 78-87-5 | ----- |
| 1,3-Dicloropropeno | 1,3-Dichloropropene | Dicloreto de Trimetileno | C3H6Cl2 | 142-28-9 | ----- |
| cis-3-Dicloropropeno | cis-1,3-Dichloropropene | DCP | C3H4Cl2 | 10061-01-5 | ----- |
| trans-1,3- Dicloropropeno | trans-1,3-Dichloropropene | trans-1,3-Dicloropropileno | C3H4Cl2 | 10061-02-6 | ----- |
| 1,1-Dicloropropeno | 1,1-Dichloropropene | 1,1-Dicloropropileno | C3H4Cl2 | 563-58-6 | ----- |
| Estireno | Styrene | Vinilbenzeno | C8H8 | 100-42-5 | 20 |
| Etilbenzeno | Ethylbenzene | Etilbenzol | C8H10 | 100-41-4 | 200 |
| Hexaclorobutadieno | Hexachlorobutadiene | Perclorobutadieno | C4Cl6 | 87-68-3 | ----- |
| Isopropilbenzeno | Isopropylbenzene | Cumeno | C9H12 | 98-82-8 | ----- |
| 4-Isopropiltolueno | 4-Isopropyltoluene | Cimeno | C10H14 | 99-87-6 | ----- |
| Metil t-butil eter | Methyl t-butyl ether | Methyl t-butyl ether (MTBE) | C5H12O | 1634-04-4 | ----- |
| Naftaleno | Naphthalene | Naftalina | C10H8 | 91-20-3 | ----- |
| n-Propilbenzeno | n-Propylbenzene | Isocumeno | C9H12 | 103-65-1 | ----- |
| Tetracloreto de Carbono | Carbon tetrachloride | Tetraclorometano | CCl4 | 56-23-5 | 2 |
| 1,1,1,2-Tetracloroetano | 1,1,1,2-Tetrachloroethane | R130a | C2H2Cl4 | 630-20-6 | ----- |
| 1,1,2,2-Tetracloroetano | 1,1,2,2-Tetrachloroethane | s-Tetracloroetano | C2H2Cl4 | 79-34-5 | ----- |
| Tetracloroeteno | Tetrachloroethene | Tetracloroetileno | C2Cl4 | 127-18-4 | 40 |
| Tolueno | Toluene | Toluol | C7H8 | 108-88-3 | 170 |
| Tribromometano | Tribromomethane | Bromoform | CHBr3 | 75-25-2 | ----- |
| 1,1,2-Tricloro-1,2,2-trifluoroetano | 1,1,2-Trichloro-1,2,2- trifluoroethane | Freon 113 | C2Cl3F3 | 76-13-1 | ----- |
| 1,2,3-Triclorobenzeno | 1,2,3-Trichlorobenzene | 1,2,3-Triclorobenzeno | C6H3Cl3 | 87-61-6 | 20 (soma de isômeros) |
| 1,2,4-Triclorobenzeno | 1,2,4-Trichlorobenzene | 1,2,4-Triclorobenzeno | C6H3Cl3 | 120-82-1 | 20 (soma de isômeros) |
| 1,1,1-Tricloroetano | 1,1,1-Trichloroethane | Clorotene | C2H3Cl3 | 71-55-6 | ----- |
| 1,1,2-Tricloroetano | 1,1,2-trichloroethane | 1,1,2-TCE | C2H3Cl3 | 79-00-5 | ----- |
| 1,1,2-Tricloroeteno | 1,1,2-Trichloroethene | Tricloroetileno | C2HCl3 | 79-01-6 | 70 |
| Triclorofluorometano | Trichlorofluoromethane | Freon 11 | CCl3F | 75-69-4 | ----- |
| Triclorometano | Trichloromethane | Chloroform | CHCl3 | 67-66-3 | ----- |
| 1,2,3-Tricloropropano | 1,2,3-Trichloropropane | Tricloropropano | C3H5Cl3 | 96-18-4 | ----- |
| 1,3,5-Trimetillbenzeno | 1,3,5-Trimethylbenzene | Mesitileno | C9H12 | 108-67-8 | |
| 1,2,4-Trimetillbenzeno | 1,2,4-Trimethylbenzene | Pseudocumeno | C9H12 | 95-63-6 | ----- |
| o-Xileno | o-Xylene | 1,2-Dimetilbenzeno | C8H10 | 95-47-6 | 300 (soma de isômeros) |
| p-Xileno | p-Xylene | 1,4-Dimetilbenzeno | C8H10 | 106-42-3 | 300 (soma de isômeros) |
| m-Xileno | m-Xylene | 1,3-Dimetilbenzeno | C8H10 | 108-38-3 | 300 (soma de isômeros) |
Dioxinas e compostos de dioxinas (DLC) são subprodutos de vários processos industriais, sendo geralmente considerados como compostos altamente tóxicos e poluentes orgânicos persistentes (POPs).
Eles incluem:
- Dibenzo -p- Dioxinas Policloradas (PCDDs) ou de forma genérica , dioxinas. Tecnicamente os PCDDs são derivados da dibenzo-p-dioxina formados após cloração.
Há 35 PCDDs e sete deles são especificamente tóxicos.
- Dibenzofuranos Policlorados (PCDFs), ou de forma genérica, furanos. Tecnicamente os PCDFs são derivados do dibenzofuranos formados após cloração. Há 75 congêneres (derivados diferindo apenas no número e
localização dos átomos de cloro).
Dez deles têm propriedade similares as dioxinas e são tóxicos.
- Bifenilas Policlorados (PCBs), que também não são dioxinas, mas doze deles têm propreiedade similares as dioxinas.
Sob certas condições PCBs podem formar dibenzofuranos mais tóxicos através da oxidação parcial.
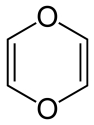
Dioxina |
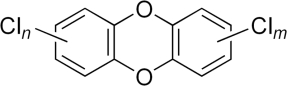
Dibenzo-p-dioxina Policlorada (PCDDs) |
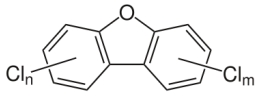
Dibenzofurano Policlorado (PCDFs) |
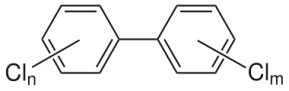
Bifenila Policlorada (PCBs) |
Outros compostos podem ter em sua estrutura a dioxina, mas por não serem clorados não apresentam toxicidade e não são persistentes.
Mesmo porque dentro das classes das Dibenzo-p-Dioxina Policloradas, Dibenzofuranos Policlorado e PCBs, suas toxicidades variam muito, foi criado o conceito de equivalência tóxica (TEQ) para facilitar a avaliação de
riscos e controles de regulamentações.
O fator de equivalência tóxica existe para sete congêneres de dioxinas, dez furanos e doze PCBs.
A referência de toxicidade é a dioxina mais tóxica ou a 2,3,7,8-tetraclorodibenzo-p-dioxina (TCDD), que por convenção tem uma TEF de 1.
Em referência a importância como tóxicos ambientais o termo dioxina é usado quase exclusivamente para se referir à soma dos compostos dos grupos acima, que demonstram o mesmo modo de ação da toxicidade específica
associada com a TCDD.
Estes incluem 17 PCDDs , 17 PCDFs e 12 PCBs.
As Dibenzo -p- Dioxinas Policloradas (PCDDs) e os Dibenzofuranos Policlorados (PCDFs) são produzidos por fontes antropogênicas, geralmente por processos de combustão incompleta e alguns processos químicos.
Elas entram no ambiente físico após processos de combustão de diversos materiais orgânicos, refino e fundição de metais, fabricação de produtos químicos clorados, branqueamento do papel, processos biológicos naturais
e fotoquímicos e mobilização de reservatórios ambientais de poluentes ambientais, como os sedimentos.
Os animais e os seres humanos podem absorver os PCDDs e os PCDFs principalmente pela ingestão de alimentos contaminados que é a principal fonte de exposição humana com aproximadamente 96%.
Os alimentos que propiciam a maior ingestão são as gorduras animais, produtos lácteos gordurosos e gordura de peixe como as de arenque, cavala, salmão, sardinha, truta e atum.
A exposição pelo ar também pode ocorrer pela respiração de gases provenientes de incineradores de resíduos hospitalares e lixo urbano, de gases liberados por plantas industriais de fábricação de papel, fornos de
cimento e fundições de metal.
Por serem os PCDDs e os PCDFs hidrofóbicos e lipossolúveis, isto significa que quando caem na água acumulam rapidamente nos animais e nos sedimentos, chegando a bioacumulação nos peixes a um nível 100000 vezes maior
que o ambiente circundante, razão porque a ingestão de água tem uma contribuição muito pequena na dose diária.
A ingestão de PCDDs e os PCDFs recomendada deve ser de 1 a 4 pg / kg de peso corporal por dia e que corresponde a uma ingestão diária de 0,000 000 000 07 a 0,000 000 000 28 g para uma pessoa de 70 kg de peso.
Os PCDDs e os PCDFs são classificados desde 1997 pela Organização Mundial de Saúde (OMS) e EPA como carcinogênico humano, principalmente o composto mais tóxico da classe, a 2,3,7, 8 - TCDD, e que não é conhecida
"dose segura" ou "limite" abaixo do qual as dioxinas não iram causar câncer.
Além do câncer, a exposição às dioxinas também pode causar graves problemas reprodutivos e de desenvolvimento (em níveis 100 vezes menores que aqueles associados com a sua carcinogenicidade).
As dioxinas são conhecidas por sua capacidade de danificar o sistema imunológico e interferir com os sistemas hormonais.
Exposição às dioxinas tem sido associada a defeitos de nascimento, incapacidade de manter a gravidez, diminuição da fertilidade, redução da contagem de espermatozóides, endometriose, diabetes, deficiências de
aprendizado, supressão do sistema imunológico, problemas pulmonares, doenças de pele, e baixos níveis de testosterona, principalmente.
Principais Dibenzo -p- Dioxinas Policloradas (PCDD) com os respectivos TEFs:
| PCDDs | TEF | PCDDs | TEF |
| 2,3,7,8-Tetraclorodibenzo-p-dioxina | 1 | 1,2,3,7,8-Pentaclorodibenzo-p-dioxina | 1 |
| 1,2,3,4,7,8-Hexaclorodibenzo-p-dioxina | 0,1 | 1,2,3,6,7,8-Hexaclorodibenzo-p-dioxina | 0,1 |
| 1,2,3,7,8,9-Hexaclorodibenzo-p-dioxina | 0,1 | 1,2,3,4,6,7,8-Heptaclorodibenzo-p-dioxina | 0,01 |
| Octaclorodibenzo-p-dioxina | 0,0003 |
Principais Dibenzofuranos Policlorados (PCDFs) com os respectivos TEFs:
| PCDFs | TEF | PCDFs | TEF |
| 2,3,7,8-Tetraclorodibenzofurano | 0,1 | 1,2,3,7,8-Pentaclorodibenzofurano | 0,03 |
| 2,3,4,7,8-Pentaclorodibenzofurano | 0,3 | 1,2,3,4,7,8-Hexaclorodibenzofurano | 0,1 |
| 1,2,3,6,7,8- Hexaclorodibenzofurano | 0,1 | 1,2,3,7,8,9-Hexaclorodibenzofurano | 0,1 |
| 2,3,4,6,7,8-Hexaclorodibenzofurano | 0,1 | 1,2,3,4,6,7,8-Heptaclorodibenzofurano | 0,01 |
| 1,2,3,4,7,8,9- Heptaclorodibenzofurano | 0,01 | Octaclorodibenzofurano | 0.0003 |
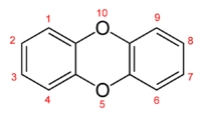
Numeração da posição da substituição dos átomos de cloro na molécula
Dibenzo-p-Dioxina.
A substituição do Dibenzofurano é similar.
Microcistinas são peptídeos cíclicos não ribosômicos produzido por cianobactérias (por exemplo, Microcystis aeruginosa ).
Elas são cianotoxinas e pode ser muito tóxico para as plantas e animais, incluindo seres humanos.
Sua hepatotoxicidade pode causar sérios danos ao fígado. Microcistinas podem inibir fortemente proteínas do tipo fosfatases 1 (PP1) e 2A (PP2A), e estão ligados a doença pansteatite ou doença da gordura amarela.
As microcistinas consistem em vários aminoácidos não proteinogénicos como os derivados da dehidroalanine e o ß-amino ácido 3-amino-9-methoxy-2,6,8,-trimethyl-10-phenyldeca-4,6-dienoic (ADDA).
Microcistina-LR é uma das mais de 80 variantes conhecidas tóxicas e é a mais estudada pelos químicos, farmacêuticos, biólogos e ecologistas.
Uma vez ingerida, as microcistinas viajam até o fígado, através do sistema de transporte de ácidos biliares, onde a maioria é armazenada, embora alguma possa permanecer na corrente sanguinea e contaminar outros tecidos.
Microcistina se liga covalentemente a proteína fosfatases, assim, interromper os processos de controle celular.
Parece haver informação adequada para avaliar o potencial carcinogénico de microcistinas através da aplicação de Diretrizes EPA para Avaliação de Risco Cancerígeno.
Alguns estudos sugerem que pode haver uma relação
entre câncer de fígado e colorectral e a ocorrência de cianobactérias na água potável na China.
As microcistinas são hidrofóbicas com uma carga ligeiramente negativa em pH de 6 a 9, possuindo massa molecular entre 909 e 1115 g/mol.
A Microcistina LR possui massa molecular de 994 g/mol.
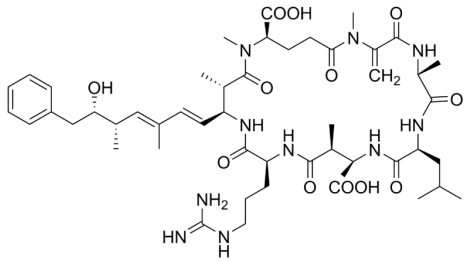
Microcistina LR
Devido a estrutura peptídica cíclica as microcistinas são muito estáveis e resistentes a hidrólise química e oxidação em pH neutro.
As microcistinas se mantém tóxicas mesmo após fervura da água. Em condições naturais, no escuro, as microcistinas podem persistir por meses ou anos. Em temperatura de 40ºC e pH 1 a hidrólise foi observada em mais de 12
semanas e em pH 10 em 10 semanas, para degradação de 90% de sua concentração.
A Portaria 518 do Ministérios da Saúde regulamente seu valor máximo na água potável de 1 µg/L.
Pesticidas são substâncias ou mistura de substâncias destinadas a prevenir, destruir, repelir ou mitigar qualquer praga. Um pesticida pode ser uma química substância, agente biológico (tal como um vírus ou bactéria),
antimicrobianos, desinfetante ou dispositivo utilizado contra qualquer praga.
Pragas incluem insetos , plantas patogênicas , ervas daninhas, moluscos , aves , mamíferos , peixes , nematóides ( lombrigas ) e micróbios que destroem propriedade, plantações, criações ou provocam doenças.
Embora haja benefícios para o uso de pesticidas, também há desvantagens, como o potencial de toxicidade para humanos e outros animais. De acordo com a Convenção de Estocolmo sobre Poluentes Orgânicos Persistentes (POPs),
9 dos 12 mais perigosos e persistentes produtos químicos orgânicos são pesticidas e entre eles estão:
Aldrin, Chlordano, DDT, Dieldrin, Endrin, Heptacloro, Hexaclorobenzeno, Mirex e Tozafeno
A subclasses de pesticidas incluem: herbicidas , inseticidas , fungicidas , raticidas , pediculicidas e biocidas. Muitos pesticidas podem ser agrupados em famílias químicas, como organoclorados ,
organofosforados e carbamatos.
Os pesticidas organoclorados operam por perturbar o equilíbrio sódio / potássio da fibra nervosa, forçando o nervo a transmitir continuamente. Sua toxicidade variam muito, mas eles foram eliminados por causa de sua
persistência e potencial de bioacumulação.
Os pesticidas organofosforados e carbamatos em grande parte substituíram os pesticidas organoclorados. Ambos operam por meio de inibir a enzima acetilcolinesterase , permitindo que a acetilcolina a transferência de
impulsos nervosos indefinidamente e causando uma variedade de sintomas como fraqueza ou paralisia.
Organofosforados são bastante tóxicos para os vertebrados, e em alguns casos, foram substituídos por carbamatos menos tóxicos. Tiocarbamato e ditiocarbamatos são subclasses de carbamatos.
Outras famílias proeminente de herbicidas incluem herbicidas fenoxi ácidos (por exemplo, 2,4-D ), triazinas (por exemplo, a atrazina ), uréias (por exemplo,diuron ), e cloroacetanilidas (por exemplo, alaclor ).
Compostos fenoxi ácidos tendem a matar seletivamente ervas daninhas de folhas largas em vez de gramíneas. As Triazinas interferirem na fotossintese photsynthesis. Existem outros pesticidas comumente usados que não
estão incluídos nessas famílias, por exemplo o glifosato.
Uso de pesticidas levanta uma série de preocupações ambientais. Mais de 98% de inseticidas pulverizados e 95% de herbicidas chegam a um destino que não seja sua espécie-alvo e poluem o ar, água e solo. A dispersão de
pesticidas pelo ar ocorre quando gotículas ou partículas formadas durante a aplicação são levadas pelo vento para outras áreas distantes, como áreas urbanas , lagos, rios e florestas de vegetação nativa.
Os pesticidas são uma das causas da poluição da água , e alguns pesticidas são os poluentes orgânicos persistentes e contribuir para a contaminação do solo . Além disso, o uso de pesticidas reduz a biodiversidade ,
reduz a fixação de nitrogênio, contribui para o declínio dos polinizadores, destrói o habitat (especialmente de aves), e coloca em risco espécies ameaçadas de extinção.
As pragas podem desenvolver uma resistência ao pesticida ( resistência a pesticidas ), necessitando de um novo pesticida. Alternativamente uma dose maior do pesticida pode ser usado para neutralizar a resistência,
embora isso irá causar um agravamento do problema da poluição ambiental.
Por estes motivos é necessário um controle rigoroso da água para os principais pesticidas que são usados ou já foram banidos, se bem como dos seus resíduos de degradação.
Os pesticidas organoclorados, usados para controle de pragas, comumente ocorrem em águas que têm sido afetados por descargas agrícolas.
Alguns dos compostos listados são produtos de degradação de outros pesticidas.
Vários pesticidas organoclorados são bioacumulativos e relativamente estáveis, podendo permanecer acumulados no solo e sedimentos por décadas após suas utilizações.
São tóxicos ou cancerígenos.
Os principais pesticidas organoclorados são listados a seguir, com as respectivas especificações, se presentes na portaria de água potável do Ministério da Saúde:
| Nome Português | Nome Inglês | Nome Comum | Fórmula | CAS | (µg/L) Máx. Portaria 518 |
| Aldrin | Aldrin | Aldocit | C12H8Cl6 | 309-00-2 | 0,03 |
| α-BHC | α-BHC | alfa-HCH | C6H6Cl6 | 319-84-6 | ---- |
| β-BHC | β-BHC | beta-HCH | C6H6Cl6 | 319-85-7 | ---- |
| δ-BHC | δ-BHC | delta-HCH | C6H6Cl6 | 319-86-8 | ---- |
| γ-BHC | γ-BHC | Lindano | C6H6Cl6 | 58-89-9 | 2 |
| Clordano | Chlordane | Orto-Clordano | C10H6Cl8 | 57-74-9 | 0,2(soma isômeros) |
| 4,4'-DDD | 4,4'-DDD | p,p-DDD | C14H10Cl4 | 72-54-8 | ---- |
| 4,4'-DDE | 4,4'-DDE | p,p'-DDE | C14H8Cl4 | 72-55-9 | ---- |
| 4,4'-DDT | 4,4'-DDT | Neocide | C14H9Cl5 | 50-29-3 | 2 (soma isômeros) |
| Dieldrin | Dieldrin | Dieldrex | C12H8Cl6O | 60-57-1 | 0,03 |
| Endrin | Endrin | Endrex | C12H8Cl6O | 72-20-8 | ---- |
| Endosulfan I | Endosulfan I | Endosulfan-alpha | C9H6Cl6O3S | 959-98-8 | ---- |
| Endosulfan II | Endosulfan II | Endosulfan-beta | C9H6Cl6O3S | 33213-65-9 | ---- |
| Endosulfan sulfato | Endosulfan sulfate | Thiodan sulfate | C9H6Cl6O4S | 1031-07-8 | ---- |
| Heptaclor | Heptachlor | Eptacloro | C10H5Cl7 | 76-44-8 | 0,03 |
| Heptaclor epoxide | Heptachlor epoxide | cis-Heptachlor Epoxide | C10H5Cl7O | 1024-57-3 | 0,03 |
| Hexaclorobenzeno | Hexachlorobenzene | Perchlorobenzene | C6H6 | 118-74-1 | 1 |
| Mirex | Mirex | Mirex | C10Cl12 | 2385-85-5 | ---- |
| Metoxicloro | Methoxychlor | Dimetoxi-DDT | C16H15Cl3O2 | 72-43-5 | 20 |
| Toxafeno | Toxaphene | Camphochlor | C10H10Cl8 | 8001-35-2 | ---- |
5.2 - DDT
De todos os inseticidas organoclorados o DDT foi o mais largamente utilizado.
O DDT é o nome técnico do composto 1,1,1-tricloro-2,2-di(4-clorofenil)etano, sendo formado principalmente pelos isômeros p,p' -DDT (77%) e pelo o,p'-DDT (15%).
É um inseticida persistente que tem seu uso restrito ou banido em vários países, exceto para campanhas de saúde pública no controle de doenças transmitidas por insetos.
O DDT e seus metabólitos podem ser transportados de um meio para outro, no ambiente, por processos de solubilização, adsorção, bioacumulação ou volatilização. Na superfície do solo ocorre a foto-oxidação do DDT, sendo
a fotodesclorinação a principal reação, que acontece em dois estágios: rápida redução do cloro alifático e lenta redução do cloro aromático.
A reação tem como produtos primários o DDE, o DDD e o ácido clorídrico. Na água, a maior parte do DDT encontra-se firmemente ligada a partículas e assim, permanece, indo depositar-se no leito de rios e mares.
O DDT, DDE e DDD são altamente lipossolúveis. Esta propriedade, aliada à meia-vida extremamente longa, tem resultado em bioacumulação, onde os níveis presentes nos organismos excedem aqueles encontrados no ambiente
circundante.
O grau de acumulação varia com a espécie, duração da exposição, concentração da substância no meio e as condições ambientais. Quando presente na água, o DDT é bioconcentrado no plâncton marinho e de água doce, em
insetos, moluscos, outros invertebrados e peixes.
Tipicamente, a exposição humana e animal não ocorre apenas ao DDT mas sim a uma mistura dos três compostos. Isto porque DDE e DDD aparecem como impurezas do DDT técnico, são produtos de degradação ambiental e são
produzidos no processo de biotransformação do DDT.
A via digestiva é considerada a mais significativa via de entrada do DDT no organismo humano, devido ao consumo de alimentos ou uso de utensílios contaminados. Os principais efeitos do DDT são: neurotoxicidade,
hepatoxicidade, efeitos metabólicos e efeitos reprodutivos e câncer.
Nos seres humanos, como em outras espécies, o DDT se biotransforma em DDE, que é acumulado mais facilmente que o DDT.
5.3 - Herbicidas Ácidos
Um herbicida ácido, mais comumente um fenoxi acido é qualquer membro de uma família de substâncias químicas relacionadas ao hormônio do crescimento ácido indolacético (IAA).
Quando pulverizado sobre as plantas de folhas grandes eles induzem o crescimento rápido e descontrolado, o que acaba matando-a.
Quando pulverizado sobre as culturas, como trigo ou milho, mata seletivamente apenas as plantas de folhas largas como as ervas daninhas, deixando as culturas relativamente pouco afetadas. Há uma grande variedade de
fenoxi ácidos em uso hoje, mais agrupados como fenoxiacéticos, fenoxibutiricos e fenoxipropionicos, este último forma o subtipo ariloxifenoxipropionico, que contém o maior número de variantes comerciais.
Quimicamente são ácidos, e normalmente são aplicados na forma de ésters ou sais. Introduzido pela primeira vez em 1946, esses herbicidas foram de uso generalizado em agricultura até meados da década de 1950.
O melhor dos herbicidas fenoxi conhecidos são ácido 2,4-diclorofenoxiacético (2,4-D) e 2,4,5-triclorofenoxiacético ácido (2,4,5-T). O 2,4,5-T por ser inerentemente contaminados com a dioxina
2,3,7,8-tetracloro-para-dioxina (TCDD) tem sido banido em muitos países.
O 2,4-D não tem esse problema, e continua sendo um dos herbicidas mais utilizados no mundo. Desta família de herbicidas os principais são listados a seguir , com as respectivas especificações, se presentes na portaria
de água potável do Ministério da Saúde:
| Nome Quimico | Nome Químico Inglês | Nome Comum | Fórmula | CAS | (µg/L) Máx. Portaria 518 |
| Ácido 2,2-dicloropropanoico | 2,2-dichloropropanoic acid | Dalapon | C3H4Cl2O2 | 75-99-0 | ----- |
| Ácido 3,6-dicloro-2-metoxibenzoico | 3,6-dichloro-2-methoxybenzoic acid | Dicamba | C8H6Cl2O3 | 1918-00-9 | ----- |
| Ácido (2,4-diclorofenoxi)-acetico | (2,4-dichlorophenoxy)-acetic acid | 2,4-D | C8H6Cl2O3 | 94-75-7 | 30 |
| Ácido (2,4,5-triclorofenoxi)-propiônico | (2,4,5-trichlorophenoxy)-propionic acid | 2,4,5-TP/Silvex | C9H7Cl3O3 | 93-72-1 | ----- |
| 2-(1-metilpropil)-4,6-dinitrofenol | 2-(1-methylpropyl)-4,6-dinitrophenol | Dinoseb | C10H12N2O5 | 88-85-7 | ----- |
| Ácido 4-amino-3,5,6-tricloropicolinico | 4-amino-3,5,6-trichloropicolinic acid | Picloram | C6H3Cl3N2O2 | 1918-02-1 | ----- |
| 3-(metiletil)-1H-2,2,3-benzotiadiazin-4(3H)-ona 2,3- | 3-(methylethyl)-1H-2,2,3-benzothiadiazin-4(3H)-one 2,3-dioxide | Bentazona | C10H12N2O3S | 25057-89-0 | 300 |
| Ácido (2,4,5-triclorofenoxi)-acético | (2,4,5-trichlorophenoxy)-acetic acid | 2,4,5-T | C8H5Cl3O3 | 93-76-5 | ----- |
| 3-fenoxibenzil (1RS) -cis, trans-3-(2,2-diclorovinil) -2,2-dimetilciclopropanocarboxilato |
3-Phenoxybenzyl (1RS)-cis, trans-3-(2,2-dichlorovinyl) -2,2-dimethylcyclopropanecarboxylate |
Permetrina | C21H20Cl2O3 | 52645-53-1 | 20 |
5.4 - Herbicidas de Outras Famílias
A especificação de água potável da Portaria 518 do Ministério da Saúde contempla herbicidas de outras famílias, como das Triazinas (Atrazina, Simazina), das cloramidas ( Alaclor, Metalaclor e Propanil),
Carbamatos (Molinato) e aminas halogenadas (Pendimetalina e Trifluralina).
| Nome Quimico | Nome Químico Inglês | Nome Comum | Fórmula | CAS | (µg/L)Máx. Portaria 518 |
| 2-Cloro-N-(2,6-dietilfenil) -N-(metoximetill)acetamida |
2-Chloro-N-(2,6-diethylphenyl) -N-(methoxymethyl)acetamide |
Alaclor | C14H20ClNO2 | 15972-60-8 | 20 |
| 1-cloro-3-etilamino-5-isopropilamino-2 ,4,6-triazina | 1-cloro-3-ethylamino-5-isopropylamino-2 ,4,6-triazina | Atrazina | C8H14ClN5 | 1912-24-9 | 2 |
| 2-Cloro-N-(2-etil-6-metill-fenil) -N-(1-metoxipropan-2-il) acetamida |
2-Chloro-N-(2-ethyl-6-methyl-phenyl) -N-(1-methoxypropan-2-yl)acetamide |
Metolacloro | C15H22ClNO2 | 51218-45-2 | 10 |
| S-Etil-N-hexametilenetiocarbamato | S-Ethyl-N-hexamethylenethiocarbamate | Molinato | C9H17NOS | 2212-67-1 | 6 |
| 3,4-Dimetil-2,6-dinitro-N-(1-etillpropil)anilina | 3,4-Dimethyl-2,6-dinitro-N-(1-ethylpropyl)aniline | Pendimetalina | C13H19N3O4 | 40487-42-1 | 20 |
| N-(3,4-Diclorofenil)propanamida | N-(3,4-Dichlorophenyl)propanamide | Propanil | C9H9Cl2NO | 709-98-8 | 20 |
| 6-cloro-N,N'-dietil-1,3,5-triazina-2,4-diamina | 6-chloro-N,N'-diethyl-1,3,5-triazine-2,4-diamine | Simazina | C7H12ClN5 | 122-34-9 | 2 |
| 2,6-dinitro-N,N-dipropil-4-(trifluorometill) Benzenamina | Benzenamine, 2,6-dinitro-N,N-dipropyl-4-(trifluoromethyl)- | Trifluralina | C13H16F3N3O4 | 1582-09-8 | 20 |
5.5 - Glifosato
Glifosato, quimicamente N-(fosfonometil) glicina, CAS [1071-83-6], fórmula C3 H8NO5P, é um herbicida pós-emergente de amplo espectro, não seletivo, que tem encontrado uso
agrícola e doméstico generalizado.
É vendido como um herbicida terrestres e aquáticos sob nome comercial Roundup ®.
Por causa da baixa toxicidade em mamíferos (LD50 = 1568 mg/ kg ratos; oral) há menos preocupação com a água e contaminação dos alimentos, do que com outros pesticidas, mas a não seletividade do herbicida pode
trazer problemas indiretos de fitotoxicidade.
O principal metabólito do glifosato é o ácido aminometilfosfônico (AMPA). O modo de ação do glifosato é inibir uma enzima envolvida na síntese dos minoácidos aromáticas : tirosina , triptofano e fenilalanina.
É absorvido através da folhagem e deslocado para pontos de crescimento. Devido a este modo de ação, ele é efetiva apenas em plantas que crescem ativamente, não sendo eficaz como um herbicida pré-emergente.
Algumas culturas têm sido geneticamente modificados para serem resistentes ao glifosato, como a soja.
Peixes e invertebrados aquáticos são mais sensíveis ao Glifosato do que os organismos terrestres.
Estudos In Vitro com mamíferos mostraram que o glifosato afeta a produção de progesterona em células de mamíferos e pode aumentar a mortalidade das células da placenta.
O glifosato é geralmente menos persistente na água do que no solo, com 12-60 dias de persistência foi observado em água de lagos do Canadá, mas a persistência de mais de um ano têm sido observados nos sedimentos de
lagoas em Michigan e Oregon (USA).
Quando o glifosato entra em contato com o solo, ele pode ser rapidamente ligados a partículas do solo e ser inativado. O glifosato livre no solo pode ser degradada por bactérias. Estudos mostraram que em solos,
meias-vidas variam de menos de três dias em terreno do Texas, para 141 dias em um local em Iowa.
Além disso, o seu metabólito, o ácido aminometilfosfônico (AMPA) foi encontrado em solos florestais suecos até dois anos após uma aplicação de glifosato.
Contaminação da água pode ocorrer através do escoamento do herbicida pela água de chuva ou pelos spray que são levados pelo vento. Atualmente é um dos herbicidas mais utilizados no Brasil e nos USA, sendo que em 2007
foram produzidos neste pais 83.000 toneladas.
A Portaria 518 do Ministérios da Saúde regulamente seu valor máximo na água potável de 500 µg/L.
Em água potável os fenóis e seus derivados apresentam baixo limiar de sabor e são prejudiciais a saúde humana. Os fenóis aparecem nas águas naturais através das descargas de efluentes industriais.
Indústrias de processamento da borracha, de colas e adesivos, de resinas impregnantes, de componentes elétricos (plásticos) e as siderúrgicas, entre outras, são responsáveis pela presença de fenóis nas águas naturais.
Os fenóis são tóxicos ao homem, aos organismos aquáticos e aos microrganismos que tomam parte dos sistemas de tratamento de esgotos sanitários e de efluentes industriais.
Em sistemas de lodos ativados, concentrações de fenóis na faixa de 50 a 200 mg/L trazem inibição, sendo que 40 mg/L são suficientes para a inibição da nitrificação. Na digestão anaeróbia, 100 a 200 mg/L de fenóis
também provocam inibição.
Estudos recentes têm demonstrado que, sob processo de aclimatação, concentrações de fenol superiores a 1000 mg/L podem ser admitidas em sistemas de lodos ativados. Em pesquisas em que o reator biológico foi
alimentado com cargas decrescentes de esgoto sanitário e com carga constante de efluente sintético em que o único tipo de substrato orgânico era o fenol puro, conseguiu-se ao final a estabilidade do reator
alimentado somente com o efluente sintético contendo 1000 mg/L de fenol.
No Estado de São Paulo, existem muitas indústrias contendo efluentes fenólicos ligados à rede pública de coleta de esgotos. Para isso, devem sofrer tratamento na própria unidade industrial de modo a reduzir o índice
de fenóis para abaixo de 5,0 mg/L (Artigo 19-A do Decreto Estadual n.º 8468/76).
O índice de fenóis constitui também padrão de emissão de esgotos diretamente no corpo receptor, sendo estipulado o limite de 0,5 mg/L tanto pela legislação do Estado de São Paulo
(Artigo 18 do Decreto Estadual n.º 8468/76) quanto pela Legislação Federal do CONAMA).
Nas águas naturais, os padrões para os compostos fenólicos são bastante restritivos, tanto na legislação federal quanto na do Estado de São Paulo. Nas águas tratadas, os fenóis reagem com o cloro livre formando os
clorofenóis que produzem sabor e odor na água.
Os principais fenóis que podem ocorrer em água são listados a seguir, com as respectivas especificações, se presentes na portaria de água potável do Ministério da Saúde:
| Nome Português | Nome Inglês | Nome Comum | Fórmula | CAS | (µg/L) Máx. Portaria 518 |
| 2-Clorofenol | 2-Chlorophenol | o-Clorofenol | C6H5ClO | 95-57-8 | ----- |
| 2-Nitrofenol | 2-Nitrophenol | o-Nitrofenol | C6H5NO3 | 88-75-5 | ----- |
| Fenol | Phenol | Ácido fênico | C6H6O | 108-95-2 | ----- |
| 2,4-Dimetilfenol | 2,4-Dimethylphenol | 1-Hydroxy-2,4- Dimethylbenzene | C8H10O | 105-67-9 | ----- |
| 2,4-Diclorofenol | 2,4-Dichlorophenol | 2,4-Diclorofenol | C6H4Cl2O | 120-83-2 | ----- |
| 2,4,6-Triclorofenol | 2,4,6-Trichlorophenol | Fenaclor | C6H3Cl3O | 88-06-2 | ----- |
| 4-Cloro-3-metilfenol | 4-Chloro-3-methylphenol | Chlorocresol | C7H7ClO | 59-50-7 | ----- |
| 2,4-Dinitrofenol | 2,4-Dinitrophenol | DNP | C6H4N2O5 | 51-28-5 | ----- |
| 2-Metil-4,6-dinitrofenol | 2-Methyl-4,6-dinitrophenol | 4,6-Dinitro-2-methylphenol | C7H6N2O5 | 534-52-1 | ----- |
| Pentaclorofenol | Pentachlorophenol | Pentaclorol | C6HCl5O | 87-86-5 | 9 |
| 4-Nitrofenol | 4-Nitrophenol | p-Nitrophenol | C6H5NO3 | 100-02-7 | ----- |
| 2,4,6-trinitrofenol | 2,4,6-trinitrophenol | Ácido pícrico | C6H3N3O7 | 88-89-1 | 200 |
Hidrocarbonetos aromáticos policíclicos ( PAHs ou HPAs), são potentes poluentes atmosféricos e consistem moléculas com anéis aromáticos fundidos e não apresentam átomos diferentes de C e H.
O naftaleno é o menor termo da série (C10H8) e consiste da fusão de dois anéis benzênicos. PAHs ocorrem naturalmente no petróleo, carvão e depósitos de alcatrão, e são produzidos como subprodutos
da queima de combustível (combustível fóssil ou biomassa).
Como um poluente, eles são motivo de preocupação porque alguns compostos foram identificados como cancerígenos , mutagênicos e teratogênicos. PAHs também são encontrados em alimentos assados.
Estudos têm mostrado que altos níveis de PAHs são encontrados, por exemplo, na carne assada em altas temperaturas, tais como grelhados e em peixe defumado.
Hidrocarbonetos aromáticos policíclicos são liposolúveis, ou seja, eles se misturam com mais facilidade com o óleo do que água. Os compostos de maior massa molecular são menos solúveis em água e menos voláteis.
Devido a estas propriedades, os PAHs no ambiente são encontrados principalmente no solo , nos sedimentos e substâncias oleosas, em vez de em água ou ar. No entanto, eles também são motivos de preocupação em partículas
suspensas no ar.
Petróleo bruto natural e depósitos de carvão contêm quantidades significativas de PAHs, decorrentes da conversão química de moléculas de produtos naturais, tais como os esteróides, aos hidrocarbonetos aromáticos.
Eles também são encontrados em combustíveis fósseis processados, piche e vários óleos comestíveis. Os PAHs são um dos poluentes orgânicos mais difundidos.
Além de sua presença em combustíveis fósseis também são formados por combustão incompleta de combustíveis como como lenha, carvão, diesel, gordura, tabaco e incenso.
Diferentes tipos de combustão provocam diferentes rendimentos na formação de PAHs em termos relativos de quantidades individuais. Assim, a queima do carvão produz uma mistura diferente de PAHs em relação ao
motor de combustão interna ou de um incêndio florestal.
Os principais PAHs que podem ocorrer em água potável são listados a seguir, com as respectivas especificações, se presentes na portaria de água potável do Ministério da Saúde:
| Nome Português | Nome Inglês | Nome Comum | Fórmula | CAS | (µg/L) Máx. Portaria 518 |
| Naftaleno | Naphthalene | Naftalina | C10H8 | 91-20-3 | ---- |
| Acenaftileno | Acenaphthylene | Acenaphthylene | C12H8 | 208-96-8 | ---- |
| Acenafteno | Acenaphthene | 1,2-Dihydroacenaphthylene | C12H10 | 83-32-9 | ---- |
| Fluoreno | Fluorene | 9H-Fluorene | C13H10 | 86-73-7 | ---- |
| Fenantreno | Phenanthrene | Phenanthrene | C14H10 | 85-01-8 | ---- |
| Antraceno | Anthracene | Anthracene | C14H10 | 120-12-7 | ---- |
| Fluoranteno | Fluoranthene | Benzo(j, k)fluorene | C16H10 | 206-44-0 | ---- |
| Pireno | Pyrene | benzo[def]phenanthrene | C16H10 | 129-00-0 | ---- |
| Benzo[a]antraceno | Benzo(a)anthracene | Benzo[b]phenanthrene | C18H12 | 56-55-3 | ---- |
| Criseno | Chrysene | Benzo[a]phenanthrene | C18H12 | 218-01-9 | ---- |
| Benzo[b]fluoranteno | Benzo(b)fluoranthene | 3,4-Benzofluoranthene | C20H12 | 205-99-2 | ---- |
| Benzo[k]fluoranteno | Benzo(k)fluoranthene | 8,9-Benzofluoranthene | C20H12 | 207-08-9 | ---- |
| Benzo[a]pireno | Benzo(a)pyrene | 3,4-Benzopyrene | C20H12 | 50-32-8 | 0,7 |
| Dibenzo[a,h]antraceno | Dibenzo(a,h)anthracene | 1,2:5,6-Dibenzanthracene | C22H14 | 53-70-3 | ---- |
| Indeno[1,2,3-cd]pireno | Indeno(1,2,3-cd)pyrene | Indenopyrene | C22H12 | 193-39-5 | ---- |
| Benzo[ghi]perileno | Benzo(ghi)perylene | 1,12-Benzoperylene | C22H12 | 191-24-2 | ---- |
| Coroneno | Coronene | Hexabenzobenzene | C24H12 | 191-07-1 | ---- |
| Benzo[e]pireno | Benzo(e)pyrene | 4,5-Benzopyrene | C20H12 | 192-97-2 | ---- |
| Benzo[j]fluoranteno | Benzo(j)fluoranthene | Dibenzo[a,jk]fluorene | C20H12 | 205-82-3 | ---- |
Óleos e graxas, de acordo com o procedimento analítico empregado, consiste no conjunto de substâncias que em determinado solvente consegue extrair da amostra e que não se volatiliza durante a evaporação do solvente a
100ºC.
Estas substâncias, ditas solúveis em n-hexano, compreendem ácidos graxos, gorduras animais, sabões, graxas, óleos vegetais, ceras, óleos minerais, etc. Este parâmetro costuma ser identificado também por MSH - material
solúvel em hexano.
Os óleos e graxas são substâncias orgânicas de origem mineral, vegetal ou animal. Estas substâncias geralmente são hidrocarbonetos, gorduras, ésteres, entre outros. São raramente encontrados em águas naturais,
normalmente oriundos de despejos e resíduos industriais, esgotos domésticos, efluentes de oficinas mecânicas, postos de gasolina, estradas e vias públicas.
Os despejos de origem industrial são os que mais contribuem para o aumento de matérias graxas no corpos d'água. Dentre os despejos podemos citar os de refinarias, frigoríficos, saboarias, etc. A pequena solubilidade
dos óleos e graxas constitui um fator negativo no que se refere à sua degradação em unidades de tratamento de despejos por processos biológicos e, quando presentes em mananciais utilizados para abastecimento público,
causam problemas no tratamento d'água.
A presença de material graxo nos corpos d'água, além de acarretar problemas de origem estética, diminui a área de contato entre a superfície da água e o ar atmosférico, impedindo, dessa maneira, a transferência
do oxigênio da atmosfera para a água.
Os óleos e graxas em seu processo de decomposição reduzem o oxigênio dissolvido elevando a DBO5,20 e a DQO, causando alteração no ecossistema aquático.
Na legislação brasileira não existe limite estabelecido para esse parâmetro; a recomendação é de que os óleos e as graxas sejam virtualmente ausentes para as classes 1, 2 e 3.
Os Art.18 e Art.19 da Lei Estadual Decreto 8468 estabelecem limites máximos de 100 e 150 mg/L de óleos e graxas nos efluentes de lançamento.
Em saneamento, sólidos nas águas correspondem a toda matéria que permanece como resíduo, após evaporação, secagem ou calcinação da amostra a uma temperatura pré-estabelecida durante um tempo fixado. Em linhas gerais,
as operações de secagem, calcinação e filtração são as que definem as diversas frações de sólidos presentes na água (sólidos totais, em suspensão, dissolvidos, fixos e voláteis).
Os métodos empregados para a determinação de sólidos são gravimétricos e para isso se emprega a balança analítica.
Nos estudos de controle de poluição das águas naturais e principalmente nos estudos de caracterização de esgotos sanitários e de efluentes industriais, as determinações dos níveis de concentração das diversas
frações de sólidos resultam em um quadro geral da distribuição das partículas com relação ao tamanho (sólidos em suspensão e dissolvidos) e com relação à natureza (fixos ou minerais e voláteis ou orgânicos).
Este quadro não é definitivo para se entender o comportamento da água em questão, mas constitui-se em uma informação preliminar importante. Deve ser destacado que embora a concentração de sólidos voláteis seja
associada à presença de compostos orgânicos na água, não propicia qualquer informação sobre a natureza específica das diferentes moléculas orgânicas eventualmente presentes que, inclusive, iniciam o processo de
volatilização em temperaturas diferentes, sendo a faixa compreendida entre 550-600°C uma faixa de referência.
Alguns compostos orgânicos volatilizam-se a partir de 250°C, enquanto que outros exigem, por exemplo, temperaturas superiores a 1000°C.
No controle operacional de sistemas de tratamento de esgotos, algumas frações de sólidos assumem grande importância. Em processos biológicos aeróbios, como os sistemas de lodos ativados e de lagoas aeradas
mecanicamente, bem como em processos anaeróbios, as concentrações de sólidos em suspensão voláteis nos lodos dos reatores tem sido utilizadas para se estimar a concentração de microrganismos decompositores da
matéria orgânica.
Isto por que as células vivas são, em última análise, compostos orgânicos e estão presentes formando flocos em grandes quantidades relativamente à matéria orgânica "morta" nos tanques de tratamento biológico de esgotos.
Embora não representem exatamente a fração ativa da biomassa presente, os sólidos voláteis têm sido utilizados de forma a atender as necessidades práticas do controle de rotina. Imagine se as dificuldades que se teria,
se fosse utilizada, por exemplo, a concentração de DNA para a identificação da biomassa ativa nos reatores biológicos.
Algumas frações de sólidos podem ser inter-relacionadas produzindo informações importantes. É o caso da relação SSV/SST que representa o grau de mineralização de lodos. Por exemplo, determinado lodo biológico pode ter
relação SSV/SST = 0,8 e, depois de sofrer processo de digestão bioquímica, ter esse valor reduzido abaixo de 0,4.
Para o recurso hídrico, os sólidos podem causar danos aos peixes e à vida aquática. Eles podem se sedimentar no leito dos rios destruindo organismos que fornecem alimentos, ou também danificar os leitos de desova
de peixes.
Os sólidos podem reter bactérias e resíduos orgânicos no fundo dos rios, promovendo decomposição anaeróbia. Altos teores de sais minerais, particularmente sulfato e cloreto, estão associados à tendência de corrosão
em sistemas de distribuição, além de conferir sabor às águas.
Analiticamente, isto é, de acordo com a metodologia analítica recomendada, detergentes ou surfactantes são definidos como compostos que reagem com o azul de metileno sob certas condições especificadas.
Estes compostos são designados "substâncias ativas ao azul de metileno" (MBAS - Metilene Blue Active Substances) e suas concentrações são relativas ao sulfonato de alquil benzeno linear (LAS) que é utilizado como
padrão na análise.
Os esgotos sanitários possuem de 3 a 6 mg/L de detergentes. As indústrias de detergentes descarregam efluentes líquidos com cerca de 2000 mg/L do princípio ativo. Outras indústrias, incluindo as que processam
peças metálicas, empregam detergentes especiais com a função de desengraxante, como é o caso do percloretileno.
As descargas indiscriminadas de detergentes nas águas naturais levam a prejuízos de ordem estética provocados pela formação de espumas. Um dos casos mais críticos de formação de espumas, ocorre no Município de
Pirapora do Bom Jesus, no Estado de São Paulo.
Localiza-se às margens do Rio Tietê, a jusante da Região Metropolitana de São Paulo, recebendo seus esgotos, em grande parte, sem tratamento. A existência de corredeiras leva ao desprendimento de espumas que formam
continuamente camadas de pelo menos 50 cm sobre o leito do rio.
Sob a ação dos ventos, a espuma se espalha sobre a cidade, contaminada biologicamernte e se impregnando na superfície do solo e dos materiais, tornando-os oleosos.
Além disso, os detergentes podem exercer efeitos tóxicos sobre os ecossistemas aquáticos. Os sulfonatos de alquil benzeno de cadeia linear (LAS) têm substituído progressivamente os sulfonatos de aquil benzeno de
cadeia ramificada (ABS), por serem considerados biodegradáveis.
No Brasil esta substituição ocorreu a partir do início da década de 80 e embora tenham sido desenvolvidos testes padrão de biodegradabilidade, este efeito não é ainda conhecido de forma segura. Os testes de toxicidade
têm sido melhor desenvolvidos e há certa tendência em passarem a ser mais utilizados nos programas de controle de poluição.
Os detergentes têm sido responsabilizados também pela aceleração da eutrofização. Além de a maioria dos detergentes comerciais empregados ser rica em fósforo, sabe-se que exercem efeito tóxico sobre o zooplâncton,
predador natural das algas.
Segundo este conceito, não bastaria apenas a substituição dos detergentes superfosfatados para o controle da eutrofização. Existem correntes atuais de pesquisadores que têm preferido o controle das fontes de
nitrogênio para barrar processos de eutrofização, considerando que existem poucas espécies de algas fixadoras do nitrogênio atmosférico.
O padrão de potabilidade fixado para Surfactantes pela Portaria 518 do Ministério da Saúde é no máximo 0,5mg/L.